はじめに
今回は、EBImageとimagerを使った、
R環境での画像処理をいろいろと紹介する。
具体的に、画像ファイルの読み込み・表示、
ヒストグラム表示、グレー画像変換、リサイズ(縮小)とかのプログラムを作成・実行してみた。
はじめに、EBImageとimagerをセットアップする。
パッケージのインストール
install.packages("BiocManager")
BiocManager::install("EBImage", force = TRUE)
install.packages("imager")
ひまわり画像をwikipediaからダウンロードして表示する
download.file関数を使って、Wikipediaからヒマワリの画像をダウンロードする。
そして、EBImageの関数群(readImage & display)を使って、読み込みと表示をやってみる。
download.file(url = "https://upload.wikimedia.org/wikipedia/commons/4/40/Sunflower_sky_backdrop.jpg",
destfile = "sunflower.jpg")
library(EBImage); options(EBImage.display = "raster")
Img <- EBImage::readImage(files="./sunflower.jpg", type = "jpg")
EBImage::display(Img)
quartz.save("Img01_sunflower.png", type="png", dpi=100); dev.off()

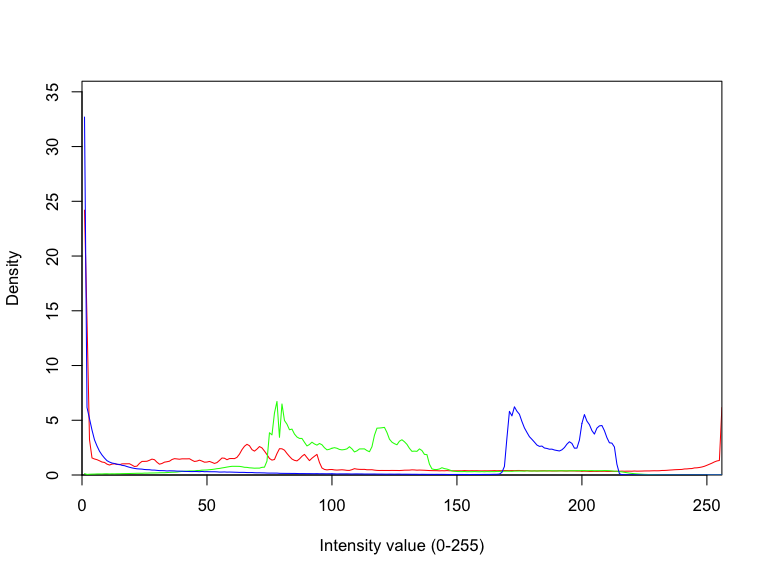
RGB画像をヒストグラムで表示する
次は、RGBのそれぞれの成分で頻度分布を計算して、ヒストグラムとして表示させる。
str(Img)
a <- hist(unlist(Img[,,1]), breaks=256); dev.off(); a <- a$red$density
b <- hist(unlist(Img[,,2]), breaks=256); dev.off(); b <- b$red$density
cc <- hist(unlist(Img[,,3]), breaks=256); dev.off(); cc <- cc$red$density
plot(a,
xlim = c(0,256), ylim=c(0, max(c(a, b, cc))*1.1),
xlab="Intensity value (0-255)", ylab="Density", xaxs="i", yaxs="i",
type="l", col="red")
lines(b, col="green")
lines(cc, col="blue")
quartz.save("Img02_rgb_histo.png", type="png", dpi=100); dev.off()
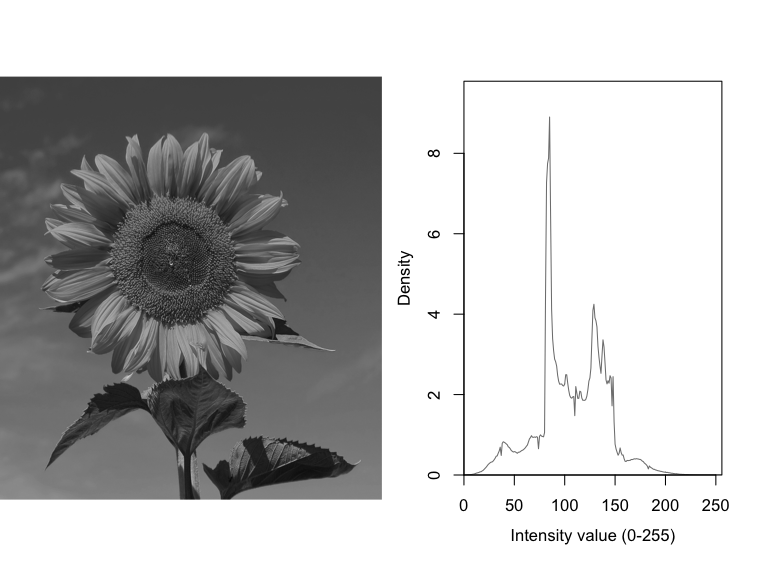
グレー画像をヒストグラムで表示する
ここでは、RGBのカラー画像をグレー画像に変換した後に、頻度分布を計算して、ヒストグラムとして表示させる。
まずは、カラー画像をグレー画像に変換する。
Img
ImgGr <- array(EBImage::channel(Img, "gray"), dim = dim(Img)[1:2])
ImgGr
EBImage::display(ImgGr)
quartz.save("Img03_sunflower.png", type="png", dpi=100); dev.off()

次に、グレー画像のヒストグラムも合わせて表示してみる。
a <- hist(unlist(ImgGr), breaks=256); dev.off()
a <- a$density
par(mfcol = c(1,2), mgp=c(2.5, 1, 0))
EBImage::display(ImgGr)
plot(a,
xlim = c(0,256), ylim=c(0, max(c(a))*1.1),
xlab="Intensity value (0-255)", ylab="Density", xaxs="i", yaxs="i",
type="l", col="grey50")
quartz.save("Img04_Grey.png", type="png", dpi=100); dev.off()
RGB画像を各成分に分離して、各画像を表示する
R成分を取り出す場合には、GとB成分にゼロを代入して、GB成分を消去する。
GとB成分でも同じような処理をやってみる。
そして、オリジナル画像、R成分、G成分、B成分の画像を連結させて表示させる。
Red <- Img
Red[,,2] <- 0
Red[,,3] <- 0
Green <- Img
Green[,,1] <- 0
Green[,,3] <- 0
Blue <- Img
Blue[,,1] <- 0
Blue[,,2] <- 0
EBImage::display(EBImage::combine(Img, Red, Green, Blue),
nx=2, all=TRUE, spacing = 0.01, margin = 70)
quartz.save("Img05_rgb.png", type="png", dpi=100); dev.off()

フィルターを変えて、画像の縮小を行い、結果を比較してみた。
EBImage::resizeとimager::resizeを使って、
様々なフィルターでの画像の縮小を試してみた。
XY軸方向に、それぞれ20%縮小した(要するに、1/25縮小)。
Img_n50 <- EBImage::resize(Img,
w=round(dim(Img)[1]/5, 0),
h=round(dim(Img)[2]/5, 0),
filter="none")
Img_b50 <- EBImage::resize(Img,
w=round(dim(Img)[1]/5, 0),
h=round(dim(Img)[2]/5, 0),
filter="bilinear")
img <- imageData(Img)
img2 <- imager::as.cimg(img, dim=dim(img))
Img_nnia50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 0)
Img_nnia50 <- EBImage::Image(Img_nnia50[,,1,], colormode = "Color")
Img_nni50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 1)
Img_nni50 <- EBImage::Image(Img_nni50[,,1,], colormode = "Color")
Img_mai50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 2)
Img_mai50 <- EBImage::Image(Img_mai50[,,1,], colormode = "Color")
Img_li50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 3)
Img_li50 <- EBImage::Image(Img_li50[,,1,], colormode = "Color")
Img_gi50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 4)
Img_gi50 <- EBImage::Image(Img_gi50[,,1,], colormode = "Color")
Img_ci50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 5)
Img_ci50 <- EBImage::Image(Img_ci50[,,1,], colormode = "Color")
Img_lani50 <- imager::resize(img2,
size_x = round(dim(img2)[1]/5, 0),
size_y = round(dim(img2)[2]/5, 0),
interpolation_type = 6)
Img_lani50 <- EBImage::Image(Img_lani50[,,1,], colormode = "Color")
EBImage::display(EBImage::combine(Img_n50, Img_b50, Img_nnia50,
Img_nni50, Img_mai50, Img_li50,
Img_gi50, Img_ci50, Img_lani50),
nx=3, all=TRUE, spacing = 0.01, margin = 70)
m <- c(0.8, 1, 0)
text(x = 100, y = 0,
label = "Img_n50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 380, y = 0,
label = "Img_b50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 680, y = 0,
label = "Img_nnia50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 100, y = 310,
label = "Img_nni50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 380, y = 310,
label = "Img_mai50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 680, y = 310,
label = "Img_li50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 100, y = 620,
label = "Img_gi50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 380, y = 620,
label = "Img_ci50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
text(x = 680, y = 620,
label = "Img_lani50", adj = c(0,1), col = "white", cex = m[1], pos=m[2], srt=m[3])
quartz.save("Img06_resize.png", type="png", dpi=150); dev.off()

n50、b50、nni50、gi50の縮小結果はあきらかに画像の平滑化がうまくいってなさそう。
nnia50の縮小結果は端っこしか切り取られていない。。
次に、画像(グレー変換後)のヒストグラムを図示してみる。
par(mfrow = c(3,3), mgp=c(2.5, 1, 0), mai = c(0.5, 0.5, 0.2, 0.2))
hist(array(EBImage::channel(Img, "gray"), dim=dim(Img)[1:2])*256,
breaks=256, freq=F, main="Img", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_n50, "gray"), dim=dim(Img_n50)[1:2])*256,
breaks=256, freq=F, main="Img_n50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_b50, "gray"), dim=dim(Img_b50)[1:2])*256,
breaks=256, freq=F, main="Img_b50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_nni50, "gray"), dim=dim(Img_nni50)[1:2])*256,
breaks=256, freq=F, main="Img_nni50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_mai50, "gray"), dim=dim(Img_mai50)[1:2])*256,
breaks=256, freq=F, main="Img_mai50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_li50, "gray"), dim=dim(Img_li50)[1:2])*256,
breaks=256, freq=F, main="Img_li50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_gi50, "gray"), dim=dim(Img_gi50)[1:2])*256,
breaks=256, freq=F, main="Img_gi50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_ci50, "gray"), dim=dim(Img_ci50)[1:2])*256,
breaks=256, freq=F, main="Img_ci50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
hist(array(EBImage::channel(Img_lani50, "gray"), dim=dim(Img_lani50)[1:2])*256,
breaks=256, freq=F, main="Img_lani50", xlab="Intensity value (0-255)",
xaxs="i", yaxs="i", ylim=c(0, 0.06))
quartz.save("Img07_histo.png", type="png", dpi=150); dev.off()
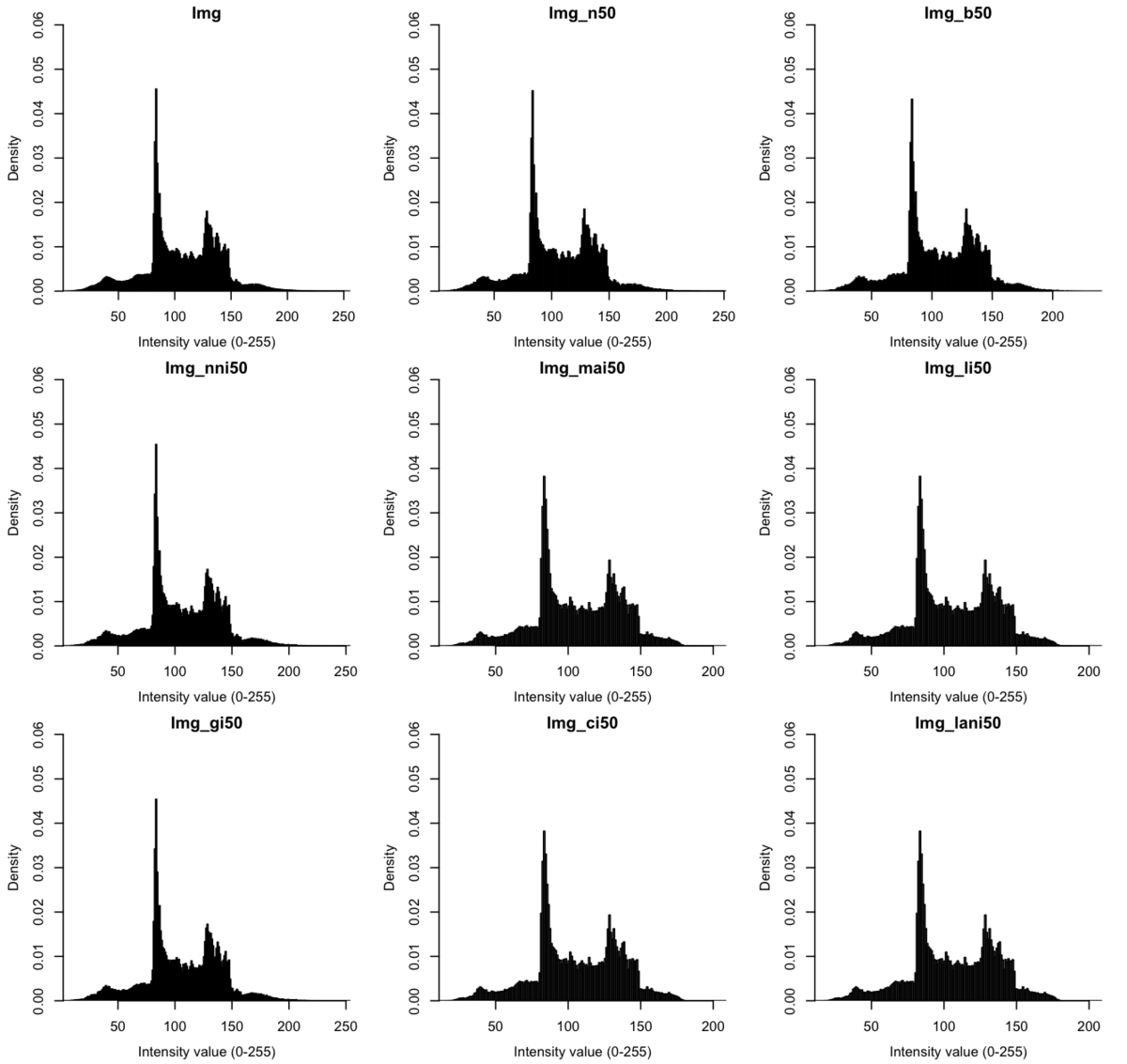
ピークの高さとか、諧調150くらいのところに少し違いがありそう。
まとめ
R/EBImage/imagerでの基本的な画像をまとめてみた。
現状、Rでの画像処理のハウツゥはほんと少ない。。
R言語でも画像処理が結構できそうなので、
少しずつスクリプトを紹介できればと思う。
参考資料
bioconductor.org
rdrr.io
www.rdocumentation.org
dahtah.github.io
rdrr.io
http://cse.naro.affrc.go.jp/takezawa/r-tips/r/55.htmlcse.naro.affrc.go.jp
labs.eecs.tottori-u.ac.jp